UDI试点实践|我国UDI系统标准体系建设蹄疾步稳
发布日期:2020年9月12日
阅读人次:552
医疗器械唯一标识(UDI)是医疗器械产品的“身份证”,由产品标识和生产标识组成,产品标识是识别注册人/备案人、医疗器械型号规格和包装的唯一代码,是从数据库获取医疗器械相关信息的“关键字”,是唯一标识的必须部分;生产标识包括与生产过程相关的信息,包括产品批号、序列号、生产日期和失效日期等,可与产品标识联合使用,以满足医疗器械流通和使用环节精细化识别和记录的需求。
医疗器械唯一标识系统(以下简称UDI系统)是医疗器械全生命周期的充分识别系统,除UDI外,还包括UDI数据载体和数据库,UDI系统建设本身也是一个标准化的过程。通过建立UDI系统,能解决当前各方自行编码形成的“万码奔腾”乱象,对规范医疗器械标识编码的格式,消除信息孤岛、降低成本、提高管理水平具有重要意义。
标准对于UDI系统实施至关重要。我国UDI系统建设的总体思路是建立法规-标准-数据库为基础的三层实施体系,首先制订《医疗器械唯一标识系统规则》(以下简称《规则》),指导开展UDI系统建设工作;再分别从UDI、数据载体和数据库方面制定标准、指南,开展标准化工作;根据UDI应用需求,逐步开展医疗器械编码信息化建设。其中,法规明确了UDI系统建设的要求和各方职责,信息化是UDI系统的具体实施落地,标准在UDI系统建设中起着承上启下的作用,一方面是对法规实施的支撑,另一方面是对具体技术环节的指导,促进UDI系统落地实施。
UDI系统标准体系主要范畴
标准体系是一定范围内的标准按其内在联系形成的有机整体,UDI系统标准体系包括UDI、UDI数据载体、UDI数据库和UDI系统应用。
UDI部分
UDI编码的唯一性直接决定着实施的成败。目前国际已经实施UDI系统的国家大多采取多家发码机构的方式,由于UDI是医疗器械的“世界语”,《规则》积极借鉴国际标准作为UDI系统建设的基本原则,标管中心在起草制订YY/T 1630-2018《医疗器械唯一标识基本要求》标准的过程中参考了国际信息技术领域通行的标准,如ISO/IEC 15459–2《信息技术—唯一标识—第2部分:注册步骤》、ISO/IEC 15459–4《信息技术—唯一标识—第4部分:单个项目》、ISO/IEC 15459–6《信息技术—唯一标识—第6部分:批项目》和ISO/IEC 646《信息技术—信息交换用7位编码字符集》,并结合医疗器械产品特点提出了UDI的基本原则、产品标识的要求和生产标识的要求,为我国UDI系统工作的开展打下了坚实的基础。
YY/T 1630-2018《医疗器械唯一标识基本要求》提出了对于UDI的基本要求,兼容当前主流的发码机构,但“码具体怎么编”是由发码机构各自的标准决定的。按照《规则》,发码机构应当向注册人/备案人提供执行其标准的流程并指导实施,应当将其编码标准上传至医疗器械唯一标识数据库并动态维护,目前中国物品编码中心、中关村中信二维码技术研究院和阿里健康科技(中国)有限公司三家发码机构将其编码标准上传至我国UDI数据库,医疗器械注册人/备案人应当结合企业实际情况选择发码机构,按照发码机构的标准创建产品标识,并确定该产品生产标识的组成。
UDI数据载体部分
目前常用的UDI数据载体有一维码、二维码、射频标签三种。一维条码成本低,是目前市面上常用的载体形式。二维条码容量大,可适用于包装过小的情况,还适用于将载体直接标识在器械本体上的技术,常见的二维码有QR码、DataMatrix码、PDF417码等。射频标签由于成本相对较高,多用于高价值器械,可以实现产品的批量出入库,减少扫码工作量,当前很多医院也在积极推广基于射频标签的耗材柜,提升医院耗材管理效率。不同形式的编码载体可以满足不同类型器械和应用场景的快速识别要求,我国UDI法规也并未对载体格式进行限制。目前常用数据载体已有相应的国家标准或国际标准,发码机构会为企业推荐适用于其编码体系的载体标准。
UDI数据库部分
《规则》明确了国家药监局制定UDI数据库相关标准及规范,国家药监局信息中心制定的两项UDI信息化标准已经发布,用于规范我国UDI数据库的建设和填报。
UDI应用部分
《规则》鼓励各相关方采用先进信息化手段、应用UDI对医疗器械在生产、经营、使用等环节进行管理。UDI的应用在各方,只有所有相关各方(从生产企业到医疗机构和患者)都在他们的工作流程系统中使用UDI,UDI系统的益处才能得到最大体现。UDI是信息化建设的有力推手,能够应用于医疗器械注册、出入库结算、追溯体系建设、不良事件召回等各方面,涉及医疗器械产品全生命周期,标准能在相关业务流程和信息交换中发挥重要作用。
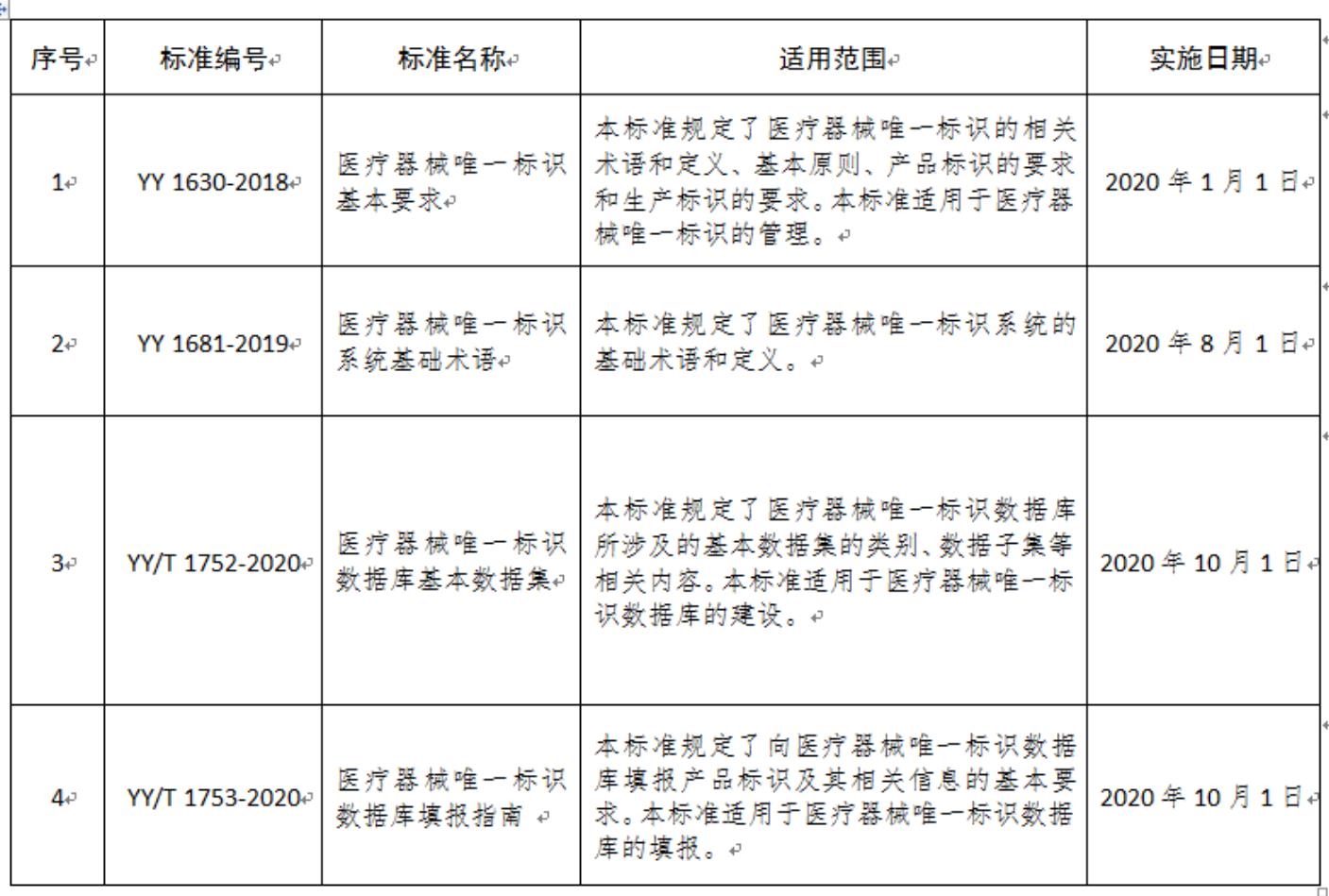
我国已发布四项UDI相关标准
目前,国家药品监督管理局制定发布了4项UDI相关标准,其中两项基础通用标准已经实施,两项信息化标准将于今年10月1日起实施,和第一批产品的实施时间保持一致。标准内容包括UDI系统的基础术语,UDI和其组成部分的基本要求,用于指导UDI数据库建设的基本数据集,指导企业数据提交的填报指南(见表)。
加快制定标准,突出各方共建
与《规则》配套的UDI相关基础通用标准和信息化标准发布后,我国UDI系统的标准体系已经初步确立。在基础通用标准中,仅包括基础术语和对UDI码的基本要求,未能涵盖全部UDI系统中的技术环节,下一步将结合试点中企业遇到的问题,如UDI中生产标识的组成以及顺序,载体放置的位置等开展关键技术研究,制定相关标准,如《医疗器械唯一标识与载体表示》《医疗器械唯一标识载体放置要求》等,并积极开展标准宣贯,发挥好引导作用。
UDI系统贯穿医疗器械注册、生产流通、使用全生命周期,建设内容涵盖标识、载体和数据库,涉及发码机构、信息技术机构和标准化机构等众多技术支撑机构。UDI系统标准体系中跨行业、跨领域的内容多,建设难度大。例如,发码机构的标准是对医疗器械注册人/备案人实施UDI系统的具体要求,也是我国UDI系统标准体系的有机组成;UDI载体标准已经在各行各业被广泛使用和验证,并非仅局限于医疗器械行业。
我国UDI系统标准体系应当多方参与,发挥各方的特长优势,创建共赢的局面。随着UDI试点的实施,为满足市场、科技发展及多样性的需求,期待更多高质量的标准出台,共同促进行业规范发展。(作者单位:国家药品监督管理局医疗器械标准管理中心)

